Pourquoi recherche-t-on E. coli?
Escherichia coli (E. coli) est une bactérie intestinale Gram négative qui réside dans le tube digestif de l’Homme et des animaux à sang chaud. Composée de plus de 150 sérogroupes différents, la grande majorité des E. coli sont inoffensives. Cependant, quelques-unes sont pathogènes pour l’Homme (Source : Institut Pasteur). C’est le cas des souches dites entérohémorragiques (ECEH). Ces dernières provoquent des diarrhées sanglantes et produisent une puissante toxine à l’origine du syndrome hémolytique et urémique (SHU).
A l’exception de ces quelques souches pathogènes, E. coli fait partie de la flore commensale de l’Homme. Elle peut même représenter jusqu’à 80% de la biomasse intestinale. En revanche, E. coli n’est pas une souche naturelle de l’environnement. La retrouver dans un échantillon d’eau signifie que celui-ci a été en contact avec des matières fécales et est donc très potentiellement contaminé par d’autres micro-organismes pathogènes pour l’homme. E. coli a donc tout logiquement été utilisée comme indicateur de contamination fécale dans l’eau potable. Ce paramètre est une limite de qualité définie dans la Directive Européenne 2020/2184. Elle doit être égale à 0 UFC dans 100 ml. A partir de 1 colonie sur une boîte de pétri, l’échantillon est positif.
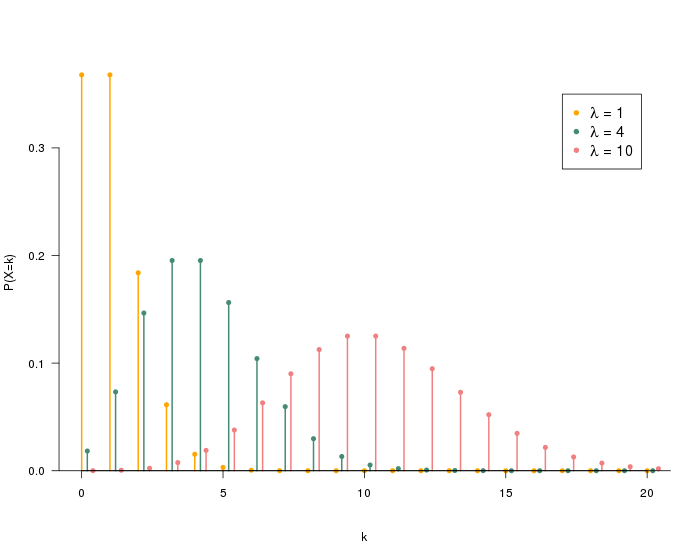
La Loi de Poisson
Cette loi de probabilité s’applique aux événements rares et est fréquemment utilisée pour les contrôles de qualité. Elle est parfaitement adaptée au dénombrement des E. coli dans l’eau potable qui demande la détection de 1 UFC dans 100 ml. La Loi de Poisson permet entre autres d’expliquer des résultats négatifs au milieu de résultats positifs pour un même échantillon.
Exemple :
On contamine un échantillon d’eau de 10 litres avec 100 UFC d’E. coli (soit 1 UFC/100ml). En réalisant 100 analyses de 100 ml d’eau, d’après la Loi de Poisson, nous obtiendrons théoriquement :
- 36% d’échantillons négatifs,
- 36% d’échantillons contenant 1 UFC/100 ml,
- 18% d’échantillons avec 2 UFC/100 ml,
- 10% d’échantillons avec 3 UFC/100 ml ou plus.
Ainsi, malgré un échantillon d’eau positif, il est très probable d’obtenir un résultat négatif. Cette distribution asymétrique est particulièrement marquée pour un nombre d’événement faible (< 5). Au-dessus de 5 événements, la distribution se rapproche de la loi normale.
Cette distribution asymétrique s’explique entre autres par la variabilité du prélèvement et la répartition non homogène des microorganismes dans l’eau.
Tout cela rend difficile la quantification de moins de 5 événements, et peut expliquer l’alternance de résultats positifs/négatifs sur un même échantillon.
Pourquoi utiliser un indicateur de contamination fécale ?
L’eau véhicule de très nombreux pathogènes pour l’eau. De ce fait, il est impossible de tous les rechercher à chaque analyse. La présence de ces pathogènes est très souvent associée à la contamination par des matières fécales. C’est pour cette raison qu’il a été décidé de travailler sur des indicateurs. La bactérie E. coli, bien connue, se multiplie rapidement ce qui la rend plus simple à identifier par rapport à d’autres indicateurs ou microorganismes pathogènes spécifiques (Santé Canada, 2012 ; WHO, 2011).
Quelles normes pour le dénombrement des coliformes et des E. coli dans l’eau potable ?
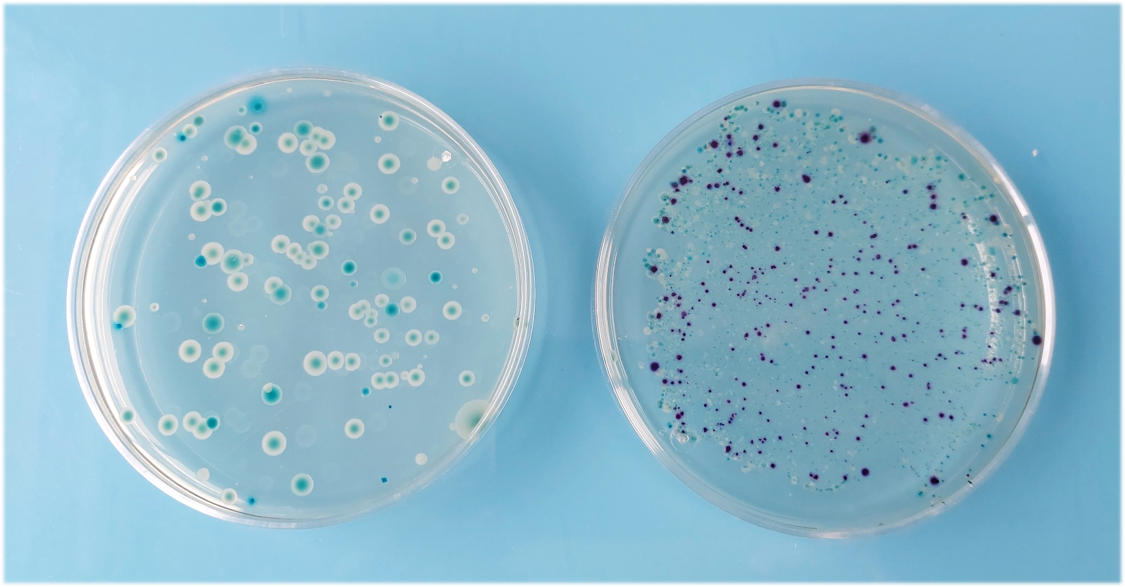
La recherche et le dénombrement des bactéries Escherichia coli (E. coli) et des bactéries coliformes dans les eaux destinées à la consommation humaine (EDCH) doit se faire selon la norme ISO 9308-1. Jusqu’en 2014, la recherche des E. coli et des bactéries coliformes était basée sur la norme éditée en 2000 comprenant une filtration des eaux à analyser sur membrane, suivie d’une mise en culture sur une gélose de différenciation lactosée TTC (Chlorure de 2,3,5-triphényltétrazolium). La confirmation de la présence d’E. coli s’effectue via sa capacité à produire de l’indole après une phase d’incubation de 24h à 44°C dans un bouillon tryptophane. La réaction de l’indole avec le réactif de Kovac donne une coloration rouge aux colonies.
En 2014, la révision de l’ISO 9308-1 propose une modification importante du principe analytique. En effet, dans cette nouvelle version, les bactéries coliformes et les E. coli sont caractérisées par la présence d’activités enzymatiques caractéristiques. Il s’agit des activités β-D-galactosidase et β-D-glucuronidase respectivement, avec une mise en évidence sur milieu gélosé CCA (Chromogenic Coliform Agar). Les bactéries sont identifiées grâce à l’apparition d’une coloration de la colonie : coloration rose à saumon pour les coliformes et coloration bleue à violette pour les E. coli. Attention, ces couleurs caractéristiques peuvent changer d’un fabricant à l’autre.
« Les deux méthodes ne sont pas équivalentes pour le dénombrement des bactéries E. coli dans les eaux d’alimentation. »*
Alors que la norme ISO 9308-1 (2014) devait totalement remplacer la version de 2000, un rapport de l’ANSES (2018), mandaté par l’État, fait état de plusieurs déviations entre les deux approches. Leurs travaux montrent un risque de déclarer injustement des résultats non conformes ou de sous-estimer un risque sanitaire avec l’ISO 9308-1 (2014). L’ANSES demande donc de faire évoluer le protocole décrit dans l’ISO 9308-1 (2014) de manière à fiabiliser les dénombrements. Par ailleurs, certaines souches d’E. coli telles qu’Escherichia coli O157 (ex : O157:H7 entérohémorragique) sont négatives à la β-D-glucuronidase. Étant par contre positives à la β-D-galactosidase, elles sont considérées comme des bactéries coliformes sur les géloses CCA.
Dès lors, la France fait coexister l’existence des deux versions de la norme. Il est possible de faire ses analyses selon la version 2014 sous accréditation COFRAC, mais l’ARS demande que les analyses réglementaires du contrôle sanitaire de l’EDCH soient réalisées selon la version de 2000.
*Rapport d’appui scientifique et technique, Septembre 2018, ANSES
Ce que l’ATP-métrie peut vous apporter
Un problème demeure quant au dénombrement des bactéries E. coli et des coliformes : le temps d’obtention des résultats. En effet, en accumulant le transport des échantillons, le temps d’incubation et le délai de traitement des résultats, il est très fréquent d’avoir le résultat d’analyse par un laboratoire accrédité 48h à 72h après le prélèvement. Or, les exploitants ont besoin d’outils rapides permettant de contrôler in-situ la qualité microbiologique de l’eau afin de réagir en temps réel face à un risque de contamination. Des méthodes alternatives telles que le Colilert d’Idexx existent. Réalisable par l’exploitant, quantitatif, et sans besoin de confirmation des colonies, il est plus rapide que la méthode traditionnelle. Cependant, elle nécessite quand même 18h d’incubation et un petit laboratoire.
Face à ce besoin de réactivité et de méthode de terrain, l’ATP-métrie quantitative DENDRIDIAG prend tout son sens. Aisément manu-portable et très simple d’utilisation, l’ATP-métrie donne le résultat en moins de 2 minutes au pied de la canalisation.
« Une méthode pour décider et agir en temps réel sur le terrain »
Les modes de désinfection utilisés étant non sélectifs, ils éliminent l’ensemble de la biomasse. L’ATPmétrie quantitative mesure la biomasse vivante totale et valide donc l’efficacité des traitements. Cet outil diagnostic permet à l’opérateur de statuer immédiatement sur l’efficacité d’une désinfection ou la nécessité d’une action corrective.
Une webapp disponible gratuitement sur smartphone donne une interprétation claire et qualifiée du résultat. En plus de la mesure microbiologique, elle intègre les paramètres physico-chimiques et donne ainsi une analyse combinatoire très robuste. Lorsque le résultat apparaît conforme cela signifie que le traitement est efficace et que le risque d’avoir une analyse E. coli ou entéro positive est minime.